Revista CIENCIA Y TECNOLOGÍA
ISSN 1810-6781 Rev. Cienc. Tecnol. 20(1): 53-61, (2024)
Impacto de la concentración de cobre en la detoxificación de soluciones cianuradas
Impact of copper concentration on the detoxification of cyanide solutions
Gustavo Raúl Fernández Essenwanger 1*  ; Emérito Gustavo Fernández Essenwanger 2
; Emérito Gustavo Fernández Essenwanger 2  ;
;
Walter Moreno Eustaquio 1  ; Gustavo Paul Fernández Chavez 3
; Gustavo Paul Fernández Chavez 3 
1Escuela de Posgrado, Universidad Nacional de Trujillo, Av. Juan Pablo II s/n – Ciudad Universitaria, Trujillo, Perú.
2Facultad de Ingeniería, Universidad Nacional de Trujillo, Av. Juan Pablo II s/n – Ciudad Universitaria, Trujillo, Perú.
3Facultad de Ingeniería Química, Universidad Nacional de Trujillo, Av. Juan Pablo II s/n – Ciudad Universitaria, Trujillo, Perú.
* Autor correspondiente: gfernandeze@unitru.edu.pe (G. Fernandez) DOI: 10.17268/rev.cyt.2024.01.04
Esta obra está publicada bajo la licencia
CC BY 4.0

Fecha de envío: 28-10-2023 Fecha de aceptación: 19-01-2024 Fecha de publicación: 08-03-2024
RESUMEN
Existen cuatro método conocidos para tratar soluciones con alto contenido de cianuro: degradación natural, oxidación química, precipitación y degradación biológica. Esta investigación, se realiza en el marco de la oxidación química, con el objetivo de demostrar la detoxificación del cianuro con peróxido de hidrógeno; y teniendo al cobre como catalizador en las soluciones cianuradas. Se evaluó el efecto de las concentraciones de cobre de 4; 5; 6 y 7 ppm para reducir los niveles de cianuro libre en las soluciones efluentes de una planta minera. Se reportó las concentraciones medias de cianuro de las soluciones en la entrada y salida, concluyendo que la concentración de cobre de 7 ppm la que obtuvo mejores resultados, disminuyendo los niveles de cianuro de 48,31 ppm a 0,018 ppm; lo cual está dentro de los Límites Máximos Permisibles (LMP) dados por el MINAM, que corresponde a 0,8 mg/L en promedio anual y 1 mg/L en cualquier momento.
Palabras clave: cianuro; detoxificación; cobre; efluentes mineros; peróxido de hidrogeno.
ABSTRACT
There are four known methods to treat solutions with high cyanide content: natural degradation, chemical oxidation, precipitation and biological degradation. This research is carried out within the framework of chemical oxidation, with the objective of demonstrating the detoxification of cyanide with hydrogen peroxide; and having copper as a catalyst in cyanide solutions. The effect of copper concentrations of 4 was evaluated; 5; 6 and 7 ppm to reduce the levels of free cyanide in the effluent solutions of a mining plant. The average cyanide concentrations of the solutions at the inlet and outlet were reported, concluding that the copper concentration of 7 ppm obtained the best results, reducing cyanide levels from 48.31 ppm to 0.018 ppm; which is within the Maximum Permissible Limits (MPL) given by the MINAM, which corresponds to 0.8 mg/L on an annual average and 1 mg/L at any time.
Keywords: cyanide; detoxification; copper; mining effluents; hydrogen peroxide.
1. INTRODUCCIÓN
Los metales como el oro y la plata son vitales para la sociedad moderna; al poseer propiedades singulares como: alta conductividad eléctrica, resistencia física y química, es necesario el proceso de extracción del metal base. El proceso de lixiviación con cianuro es el método de recuperación de oro y plata más utilizado, siendo considerado una tecnología hidrometalúrgica competente (Garza-Román et al., 2021).
La lixiviación con cianuro es un tratamiento que se utiliza desde hace 100 años para la recuperación primaria del oro, especialmente en gran y mediana minería. En la pequeña minería, su uso es bastante reciente porque algunos materiales que contienen oro (refractario u oro fino), no pueden concentrarse satisfactoriamente mediante ningún método gravimétrico; en los últimos años se utiliza la cianuración en la pequeña minería aurífera de los países andinos como Venezuela, Ecuador, Perú, Colombia, Chile y algunos países africanos (Wotruba et al., 1998).
Las plantas que lixivian los minerales de oro, utilizan soluciones cianuradas y generan cantidades significativas de desechos, generalmente valores de pH elevados. Los efluentes producidos del proceso contienen cianuro de sodio, compuestos de cianuro altamente solubles, cianatos, tiocianatos y cianuros que forman complejos con metales pesados. Estos efluentes tienen la capacidad de ser tóxicos y tienen diferentes niveles de resistencia y capacidad de tratamiento (Marsden y House, 2006). Además, el agua del proceso (con niveles de cianuro superiores a los valores permitidos) suelen almacenarse en estanques de relaves donde la contaminación se descompone naturalmente antes de su descarga. Esta práctica plantea un riesgo importante para el medio ambiente, ya que el equipo de contención puede fallar durante el almacenamiento (Fernández Pérez et al., 2021).
En términos generales, los compuestos de cianuro más comunes que se encuentran en los efluentes de las plantas de lixiviación de oro son los de hierro, níquel, cobre, zinc, cobalto y cadmio, mientras que el cianuro aparece en forma ionizada como CN- y HCN, esto es debido a su gran poder de hidrólisis; la parte negativa de estas formas de cianuro es que son tóxicos para los animales, plantas y para el hombre (Marsden y House, 2006; Mas et al., 2009). La vida media atmosférica del cianuro de hidrógeno oscila entre 1 a 3 años; existe principalmente en forma de gaseosa. Los complejos de cianuro se mueven fácilmente a través del suelo para formar el cianuro de hidrógeno (HCN), evaporándose posteriormente; otros complejos de cianuro se convierten en otras composiciones químicas por efecto de microorganismos del suelo (Ascuña et al., 2018).
Las plantas mineras tienen la obligación de realizar un tratamiento a estos efluentes, entre los diferentes métodos que existen para este tratamiento, existen uno conocido como detoxificación. Este método consiste en utiliza al peróxido de hidrógeno (H2O2) como reactivo y al sulfato de cobre pentahidratado (CuSO4.5H2O) como catalizador, con estos dos compuestos se busca oxidar a la molécula de cianuro (CN-) a cianato (OCN-), para luego precipitar como complejos insolubles fácilmente separable por un proceso de sedimentación mediante floculante. La velocidad de la reacción, las concentraciones finales de los productos de la reacción y el rendimiento de la reacción son algunos de los factores que afectar a las características del proceso. Las concentraciones finales de cianuro libre en solución dependen del reactivo utilizado para la oxidación, los reactivos adicionales agregados (catalizadores) y las condiciones de operación (Colmenares, 2007; Díaz y Condori, 2009).
Adoptar buenas prácticas de gestión para procesar e implementar métodos limpios en el proceso de recuperación de oro, no solo tendrá un impacto positivo en el medio ambiente, sino que también permitirá a los mineros tradicionales realizar sus actividades económicas sin problemas legales, ya que ayudará en algunos casos a legitimar el proceso y adecuarlo a estándares ambientales, además de permitir que la minería siga siendo una actividad económica importante para las grandes empresas como para la minería tradicional (Estrada-Montoya et al., 2020).
La figura 1 representa el equilibrio del pH entre los iones CN- y HCN. A un pH menor o igual a 8 se encuentra el HCN y para un pH de 10,5 se encuentra el CN-. Aproximadamente, a un pH de 9 coexisten ambos iones en concentraciones similares.
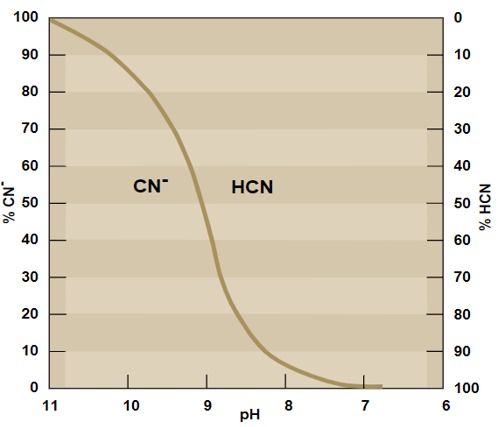
Figura 1. Equilibrio de CN-/HCN con el pH
Nota. (Logsdon et al., 2001)
Para el presente trabajo de investigación, se trabajó con la oxidación química con H2O2 para degradar el cianuro libre del proceso de lixiviación en la planta destinada al tratamiento de efluentes de la empresa minera Coimolache, en el departamento de Cajamarca, provincia de Hualgayoc.
2. METODOLOGÍA
La fuente de investigación se ajusta a un tipo de estudio prospectivo, longitudinal, comparativo y experimental.
2.1 Material de estudio:
2.1.1 Población:
Estuvo conformada por el total de muestras de soluciones cianuradas por detoxificación.
2.1.2 Muestra:
Estuvo conformada por el total de muestras de soluciones cianuradas por detoxificación.
2.2 Métodos y técnicas
2.2.1 Análisis de Datos:
Para el diseño completamente al azar, se utilizó la prueba F del análisis de varianza en el análisis de datos.
Si la probabilidad de error es menor al 5%, la prueba se considera significativa (p < 0,05).
Se comparó el análisis con la prueba POSTANOVA de Duncan, que tiene el mismo nivel de significancia.
2.2.2 Preparación de Solución valorada de Nitrato de Plata 0,01 N:
Disolver en agua 1,7 g de AgNO3 previamente secado durante un máximo de una hora a 110°C y diluir exactamente a 1 litro. Almacenar la solución en un frasco ámbar para protegerlo de la luz solar.
2.2.3 Estandarización del Método de titulación con solución de AgNO3 :
Tomar alícuotas de 25 ml de solución de Cloruro de Sodio 0,01 N en tres vasos de 250 ml, diluir aproximadamente a 50 ml enjuagando las paredes del vaso, agregar 1 ml de K2CrO4 al 5% y titular con solución de AgNO3 0,01 N hasta que aparezca el primer color rojo (pardo rojizo).
Durante la titulación el contenido del vaso se agita enérgicamente a fin que se establezca el equilibrio de adsorción.
2.2.4 Preparación de rhodanine:
Disolver 0,2 g de 5-(4-dimethylaminobenzylidene) rhodanine en 100 ml de acetona. Se añaden 5 a 7 gotas de este indicador a la solución.
“El cobre elemental se puede detectar utilizando este indicador (colorante). El cobre pasa de color rojo a anaranjado cuando se titula con rhodanine” (Madakshira et al., 2018).
2.2.5 Cálculo de Cianuro Libre:
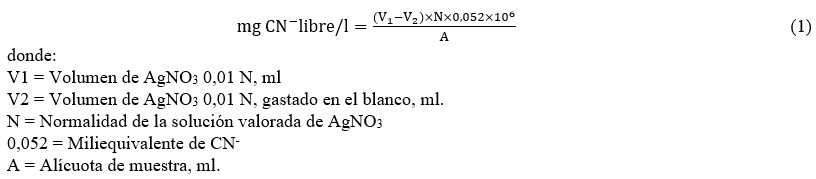
2.2.6 Cálculo de concentración de cobre en soluciones cianuradas:
La concentración de cobre se determina por la cantidad de cobre en las soluciones de lixiviación, las cuales son leídas en el Espectrofotómetro de absorción atómica VARIAN 280, para luego ser calculadas y reportadas.
La solución de cianuro se recicla continuamente al PAD de lixiviación a un caudal que oscila generalmente de 850 a 1100 m3/h, que puede ser menor dependiendo la cantidad de oro requerida. La planta Merrill Crowe aumentó la concentración de cianuro de esta solución para permitir la precipitación del oro, desde 100-120 ppm de cianuro libre. El propósito de establecer este último valor fue lograr una mayor extracción de plata, ya que es suficiente con aumentarlo a 100 ppm de cianuro libre para precipitar el oro (Colmenares, 2007).
El sulfato de cobre tiene la función de catalizador y agente de oxidación de cianuro, incluso da lugar a la formación de complejos metálicos de cianuro e hidróxidos como precipitados. Las posibles reacciones son las siguientes: (Lima et al., 2019):
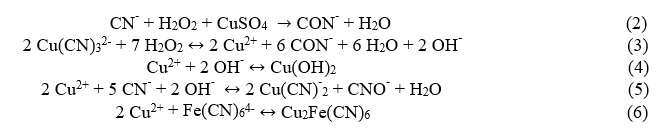
3. RESULTADOS Y DISCUSIÓN
Se tomaron en cuenta periodos de tiempo de enero y diciembre del año 2013 para evaluar la remoción de cianuro al utilizar diferentes concentraciones de cobre en soluciones cianuradas.
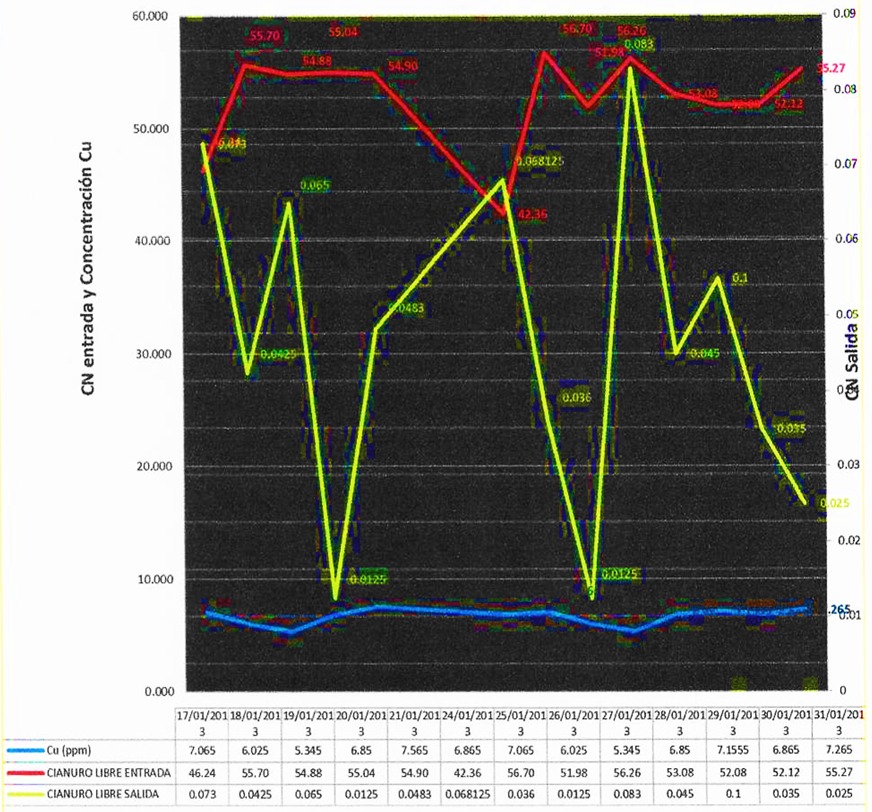
Figura 2. CN entrada, CN Salida Vs concentración de Cu en enero 2013
Nota. Datos obtenidos de la planta de tratamientos de efluentes de la empresa minera Coimolache.
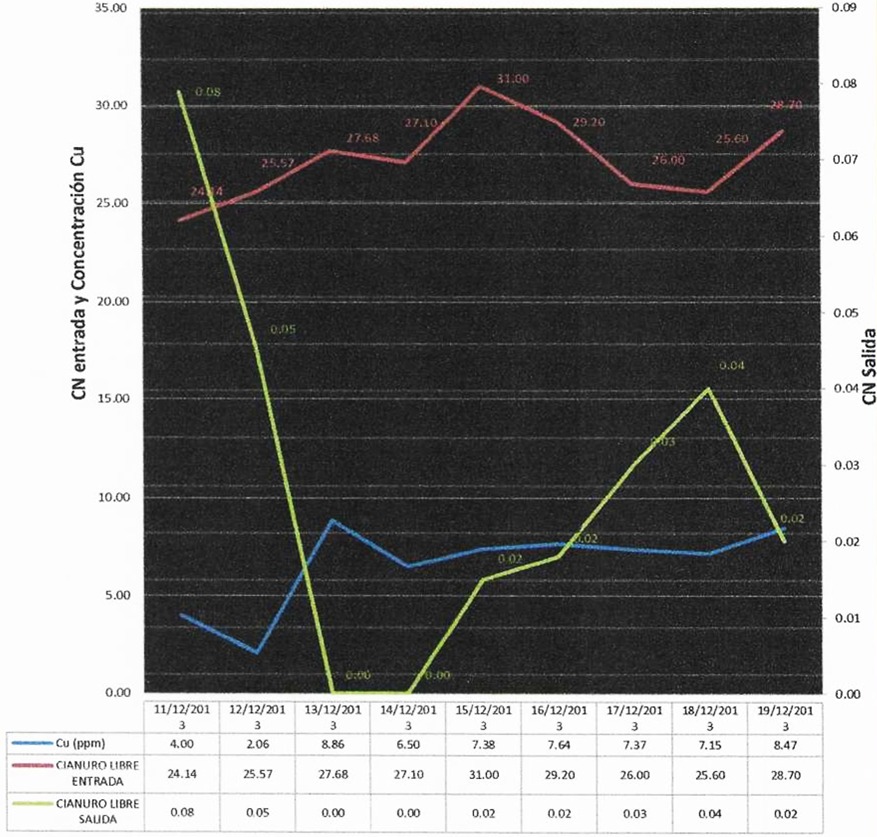
Figura 3. CN entrada, CN Salida Vs concentración de Cu en diciembre 2013
Nota. Datos obtenidos de la planta de tratamientos de efluentes de la empresa minera Coimolache.
De la figura 3, se observa un ingreso de cianuro entre rangos de 24 a 29 ppm y una salida entre rangos de 0.08 a 0.02 ppm, con concentraciones de cobre de 4; 6; 7 y 8 ppm. Por lo tanto, el cobre actúa como catalizador lo que acelera la reacción, pero la remoción de la concentración de cianuro se logra con todas las concentraciones de cobre utilizadas.
En este punto, se puede establecer que la concentración de cobre influye de manera indirecta a la concentración de cianuro, mientras mayor sea la concentración de cobre, más disminuye la concentración de cianuro libre llegando a niveles muy por debajo de lo establecido por el MINAM en los Límites Máximos Permisibles (LMP).
Tabla 1. Nivel de cianuro libre de entrada de las soluciones cianuradas por detoxificación según concentración de cobre
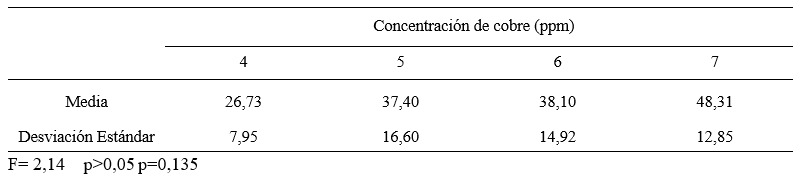
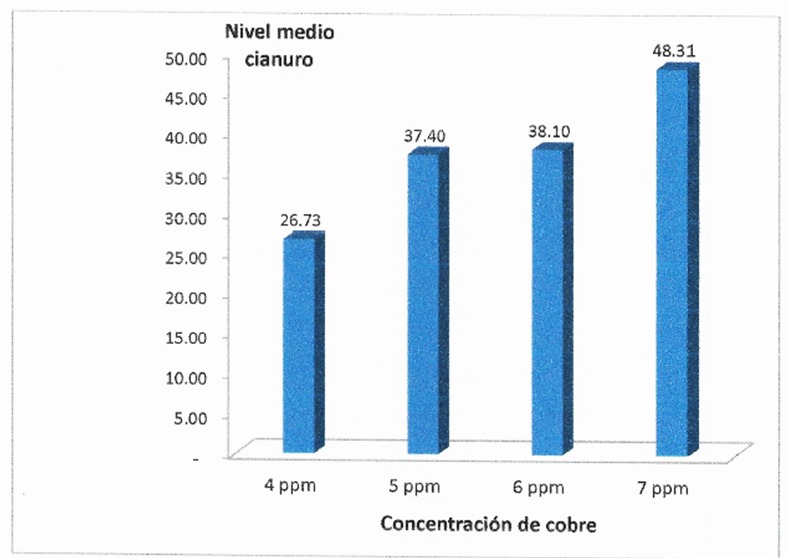
Figura 4. Nivel de cianuro libre de entrada de las soluciones cianuradas por detoxificación según concentración de cobre.
Nota. Autoría propia a partir de los datos obtenidos de la planta de tratamientos de efluentes de la empresa minera Coimolache.
En la tabla 1, se aprecia el nivel del cianuro libre de entrada de las soluciones cianuradas por detoxificación, en cada grupo de estudio sobre concentración de cobre. Se distingue un mayor nivel de cianuro libre de entrada en los grupos de mayor concentración de cobre, sin embargo la prueba F del análisis de varianza no encuentra diferencias suficientes para declarar una diferencia estadística con la finalidad significativa(p > 0,05); con la finalidad de hacer un análisis más refinado de la variable respuesta se considera al nivel de cianuro libre de entrada como variable concomitante, situación que permite que esta variable de entrada no tenga incidencia sustantiva en el análisis de los resultados de la variable respuesta.
Tabla 2. Nivel de cianuro libre de salida de las soluciones cianuradas por detoxificación según concentración de cobre.
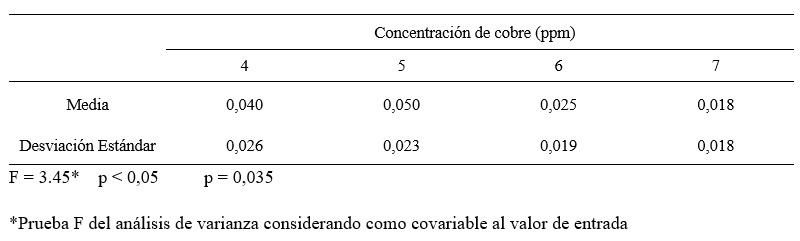
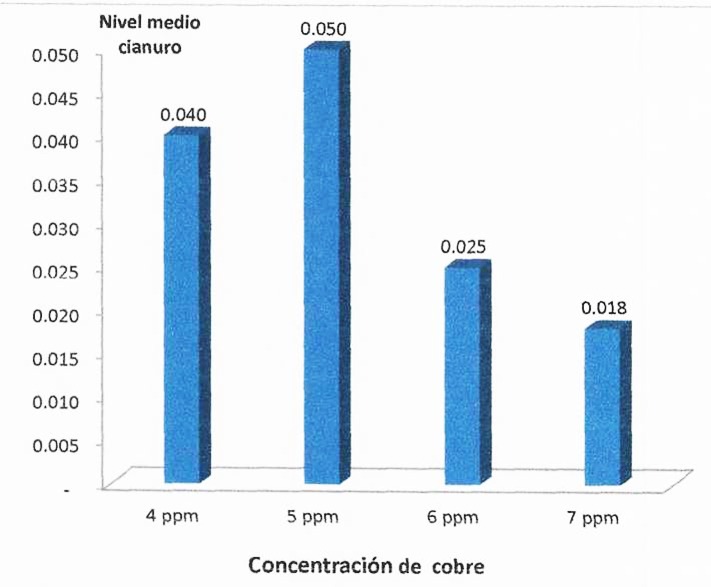
Figura 5. Nivel de cianuro libre de salida de las soluciones cianuradas por detoxificación según concentración de cobre.
Nota. Autoría propia a partir de los datos obtenidos de la planta de tratamientos de efluentes de la empresa minera Coimolache.
En la tabla 2 al comparar el nivel de cianuro libre de salida, considerando como variable concomitante al nivel de cianuro libre de entrada (covariable), el análisis de covarianza, que asuma niveles similares; es decir, detecta una diferencia estadística significativa (p < 0,05), es decir al menos una concentración de cobre produce un efecto medio diferente en la detoxificación del cianuro libre.
Tabla 3. Comparación del nivel medio de cianuro libre de salida de las soluciones cianuradas por detoxificación, por parejas, según concentración de cobre.

En la tabla 3 aparece la comparación por parejas de concentración de cobre, del nivel de cianuro libre de salida. La prueba de comparaciones múltiples de Duncan nos indica que tanto la concentración de cobre de 6 ppm y 7 ppm tienen un mayor efecto y no difieren estadísticamente (p > 0,05) y que por lo tanto si los costos no difieren de manera sustantiva puede optarse por usar alguna de ellas de preferencia el de 7 ppm ya que arroja un menor promedio, por otro lado como la tendencia tiende a mejorar al aumentar la concentración de cobre deberá ensayarse, si las condiciones son viables, con una mayor concentración de cobre.
Se reafirma en lo que se plantea en la hipótesis, en donde que existe diferencia al aumentar la concentración de Cu, el porcentaje de degradación de cianuro total aumenta, por lo que los niveles de cianuro libre en el efluente disminuyen. Además, obteniendo valores mínimos en la concentración de cianuro, reafirmamos que el cianuro total se encuentra por debajo de los LMP. Esto se debe a que el peróxido de hidrógeno oxida tanto cianuros libres como complejos de ligadura débil CN-, HCN, Cd(CN)22-, Zn(CN)22-, Cu(CN)2, Cu(CN)32-, Cu(CN)43-. Por el contrario, el aurocianuro, ferro y ferrocianuros no son oxidados por el peróxido de hidrógeno y el Cu2+ como catalizador.
El ion ferrocianuro puede separarse de la solución por precipitación con iones cobre o hierro, los cuales están presentes, en el caso del hierro, cuando reacciona el cloruro férrico con los complejos de arsénico. Existe oxidación de complejos de cianuro, pero no alcanza valores por debajo de los límites máximos permitidos según MINAM, pero a partir de una concentración de 0,80 ml/l de H2O2 logramos obtener concentraciones por debajo de estos límites.
Este resultado implica que usando una concentración de 0,80 ml/l de H2O2, se excede el costo operativo en la degradación de cianuro total; se debe tener en cuenta que al haber cobre en la solución no es necesario el uso de sulfato de cobre como catalizador, por lo tanto, hay un exceso en el consumo de peróxido de hidrógeno, con respecto a la investigación que se tomó como antecedente, pero en este caso se obvió el uso del sulfato de cobre teniendo como resultado la reducción de costos.
Al comparar con otras investigaciones, como es el caso de Morillo Esparza et al. (2019), quienes obtuvieron resultados favorables al utilizar una combinación de peróxido de hidrógeno (H2O2) y ozono (O3) en proporción 10:1 respectivamente (10 mg H2O2/mg O3), reduciendo así niveles de cianuro de 172,5 mg/l a 0,08 mg/l a pH 11; valores que también se alcanzan en la presente investigación, de 48,31 ppm a 0,018 ppm. Por lo tanto, la oxidación con H2O2 es acertada para reducir concentración de cianuro libre (CN-) en soluciones cianuradas.
4. CONCLUSIONES
Desde una perspectiva medioambiental, el peróxido de hidrógeno es la alternativa más viable debido a que tiene la ventaja de descomponer todas las formas de cianuro, incluido el hexacianoferrato. El exceso de peróxido H2O2 se degrada fácilmente en agua y oxígeno, por lo tanto, este compuesto no causa contaminación en el ambiente acuático. Cabe mencionar también que una solución de H2O2 es suministrada al 2% a 3% al cuerpo del paciente intoxicado con cianuro, como antídoto.
Siempre y cuando se tengan las condiciones adecuadas, el cianuro residual de los del proceso de cianuración en una planta concentradora de oro, puede degradarse hasta los límites aceptables. El método de oxidación con peróxido de hidrogeno requiere de unos 3,5 kg H2O2/kg de CN-, y demora 2,5 horas. Es necesario trabajar con pH mayor a 10,5 para prevenir la hidrólisis del cianuro y la posterior formación del ácido cianhídrico.
El tratamiento con peróxido de hidrogeno requiere kg H2O2 / kg de CN-, es una relación óptima debido al ajuste del modelo por un polinomio cuadrático, que nos predice que más de un aumento de la relación no logrará degradar nada de CN- libre.
Se sabe que el catalizador Cu acelera la degradación del CN- por peróxido de hidrógeno, por eso se utiliza la solución de Cu disuelto que viene con el relave de la planta. Por lo tanto, se determinó la influencia del Cu en la degradación de cianuro mediante oxidación con peróxido de hidrógeno, de los efluentes de la Compañía Minera Coimolache S.A.C. logrando obtener concentraciones inferiores a los límites máximos permisibles.
Se demostró que, teniendo soluciones cianuradas con concentraciones de 4; 5; 6 y 7 ppm de Cu, la reacción de degradación de cianuro forma su propio catalizador. Siendo la concentración de 7 ppm la que logró remover mayor concentración de cianuro libre y reducirlo a niveles de 0,018 ppm que tenían inicialmente 48,31 ppm en promedio.
5. RECOMENDACIONES
En base a los resultados y bajo los mismos procedimientos se recomienda el tratamiento de las soluciones barren de esta planta de cianuración con H2O2, FeCl3 y NaSH; porque se ha demostrado que, si llegamos a los Límites Máximos Permisibles de 1 ppm en cianuro total, 0,05 ppm en arsénico y de 0,002 ppm en mercurio, los cuales se recomienda en situaciones de drenaje hacia aguas subterráneas y en situaciones de lluvias.
Realizar pruebas con soluciones de más altas concentraciones de Cu en solución de minerales oxidados para determinar si el tipo de mineral facilita la degradación de cianuro, arsénico y mercurio con estos reactivos: H2O2l FeCI3 y NaSH respectivamente.
Se recomienda llevar a cabo pruebas con otras tecnologías; entre éstas, está el uso de reductores químicos derivados del SO2 que deshacen cianuros tales como: bisulfito de amonio, bisulfito de sodio, metabisulfito de sodio, sulfito de sodio y tiosulfito de amonio.
REFERENCIAS BIBLIOGRÁFICAS
Ascuña R., V. B., Zela O., J. G., Bolaños S., H. G., Mamani C., P. L., Huamani B., R. P., y Huanca Z., P. K. (2018). Tratamiento de soluciones de cianuro y precipitación de metales cianicidas por reacción con peróxido de hidrógeno y soda caustica, el método perso; obtención de lodos económicamente útiles. Revista Boliviana de Química, 35(5), 161–167. http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S0250-54602018000500005&lang=es
Colmenares Mayanga, W. (2007). “Efecto del pH y la Concentración de Sulfato de Cobre sobre la Degradación del Cianuro de Sodio en Solución Acuosa Utilizando el Proceso SO2/Aire.” https://www.ingenieriaquimica.org/articulos/degradacion_cianuro_sodio
Díaz Inocente, D. K., y Condori Ccoilo, I. R. (2009). Proceso de detoxificación de soluciones cianuradas usando el método Inco en efluentes mineros [Tesis de pregrado, Universidad Nacional de Ingeniería]. https://repositorio.uni.edu.pe/handle/20.500.14076/1020
Estrada-Montoya, C. C., Galeano Vanegas, N. F., y Restrepo Franco, G. M. (2020). Evaluation of cyanide and heavy metals removal in liquid effluents from small mining’s gold benefit, by adsorption with activated carbon and hydrogen peroxide in Segovia, Antioquia. DYNA (Colombia), 87(212), 9–17. https://doi.org/10.15446/dyna.v87n212.79716
Fernández Pérez, B., Viña Mediavilla, J. J., Ayala Espina, J., y Ania, C. O. (2021). Eficacia del Permanganato potásico en la degradación de Cianuro y Tiocianato en aguas residuales mineras. Revista Internacional de Contaminación Ambiental, 37, 109–117. https://doi.org/10.20937/RICA.53701
Garza-Román, M. R., Carrillo-Pedroza, F. R., Picazo-Rodríguez, N. G., Soria-Aguilar, M. de J., Almaguer-Guzmán, I., y Chaidez-Félix, J. (2021). Efectos del medio de pretratamiento y lixiviación sobre la eficiencia de extracción de Au y Ag de un subproducto de la lixiviación de calcopirita. DYNA (Colombia), 88(218), 119–126. https://doi.org/10.15446/dyna.v88n218.90284
Lima H., E. R., Hau M., L. F., Suero R., A. F., Huamaní B., R. P., Aliaga V., I. E., Ascuña R., V. B., y Cruz P., S. (2019). Estudio de los efluentes líquidos de complejos cianurados para la reutilización industrial mediante el Método de Jarras. Revista Boliviana de Química, 36(1), 10–18. http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S0250-54602019000100002
Logsdon, M. J., Hagelstein, Karen., y Mudder, Terry. (2001). El manejo del cianuro en la extracción de oro. International Council on Metals and the Environment.
Madakshira, M. G., Das, A., Umair, M., y Dutta, U. (2018). Liver histology and histochemistry in Wilson disease [Histología e histoquímica hepática en la enfermedad de Wilson]. Autopsy and Case Reports, 8(3). https://doi.org/10.4322/acr.2018.026
Marsden, J. O., y Iain House, C. (2006). The Chemistry of Gold Extraction (2nd ed.). Society for Mining, Metallurgy, and Exploration, Inc.
Mas, M., Aguirre, F., Amaya, G., Torres, F., y Marchevsky, N. (2013). Procesos de destrucción de complejos cianurados. https://fcai.uncuyo.edu.ar/upload/14amtc-mas-unlp.pdf
MINAM. (2010, August 21). Aprueban Límites Máximos Permisibles para la descarga de efluentes líquidos de Actividades Minero - Metalúrgicas DECRETO SUPREMO N° 010-2010-MINAM. El Peruano, 424114–424117. https://sinia.minam.gob.pe/normas/aprueban-limites-maximos-permisibles-descarga-efluentes-liquidos
Morillo Esparza, J., Cevallos Cueva, N., Sandoval Pauker, C., Vargas Jentzsch, P., y Muñoz Bisesti, F. (2019). Tratamiento combinado con el uso de ozono para la remoción de cianuro de efluentes: una comparación. Revista Internacional de Contaminación Ambiental, 35(2), 459–467. https://doi.org/10.20937/RICA.2019.35.02.16
Wotruba, H., Hruschka, F., Hentschel, T., y Priester, M. (1998). Manejo ambiental en la pequeña minería (MEDMIN y COSUDE, Eds.).